

El Gobierno exige el retiro urgente de esta medicación muy utilizada por un grave error en su etiquetado. Se ha detectado que un lote de Cefazolin for Injection, USP de Sandoz contiene por error viales de Penicillin G Potassium for Injection, lo que podría exponer a los pacientes a efectos adversos graves.
Este llamado a la acción se produce luego de que la FDA publicara el 27 de junio de 2025 que se trata de un retiro voluntario a nivel nacional, aunque el Gobierno local ha instado a hacerlo de manera obligatoria dada la alta incidencia de uso de este antibiótico en hospitales y clínicas, especialmente en procedimientos quirúrgicos y tratamiento de infecciones graves.
El Gobierno exigió el retiro urgente de esta medicación muy consumida
Sandoz Inc. inició el retiro voluntario del lote PG4360 de Cefazolin for Injection, USP de 1g en viales, fabricado por Sandoz GmbH y distribuido por Sandoz Inc., con fecha de vencimiento en noviembre de 2027. El error se detectó tras una queja de un cliente que identificó cuatro viales de Penicilina G Potásica, un antibiótico distinto y de uso diferente, dentro de una caja de Cefazolina de 25 unidades.
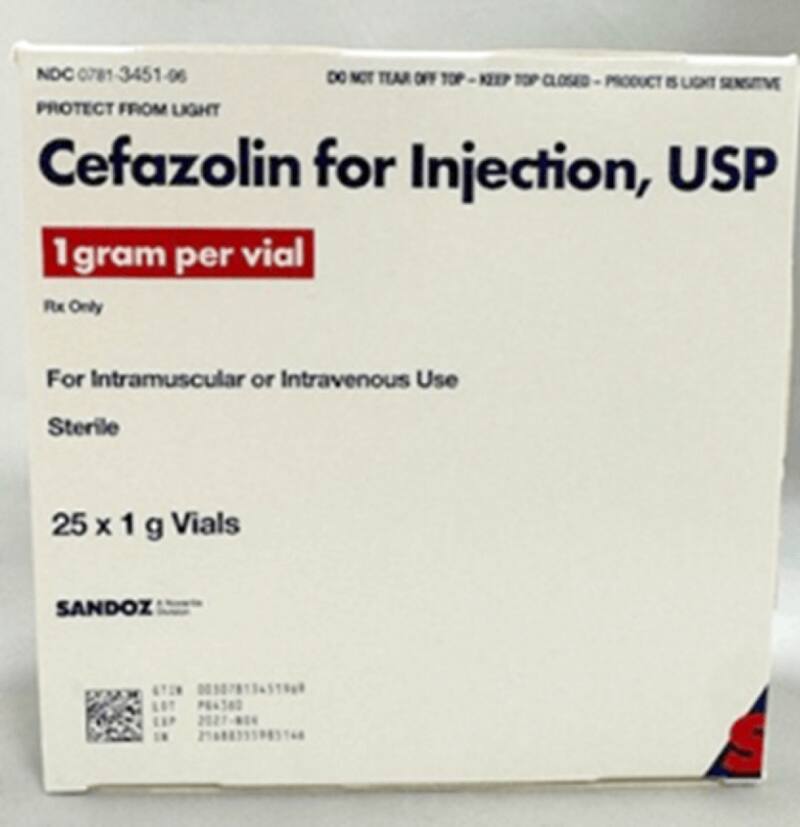
Aunque hasta el momento no se han reportado efectos adversos graves, se registró al menos un caso en que se administró accidentalmente Penicilina en lugar de Cefazolina. Las consecuencias de este fallo pueden ser serias: desde fallas en el tratamiento de infecciones, aumento de resistencia bacteriana y reacciones alérgicas, hasta arritmias por exceso de potasio en pacientes con insuficiencia renal.
¿Cuáles son las consecuencias de utilizar esta medicación en mal estado?
El uso incorrecto de Penicilina G en lugar de Cefazolina compromete la eficacia del tratamiento, ya que cada antibiótico combate distintas bacterias. Ante este tipo de errores, la salud pública se encuentra en riesgo, al igual que la confianza en la distribución de medicamentos esenciales .
El Gobierno ha solicitado a Sandoz que refuerce sus controles de calidad y etiquetado, además de implementar inspecciones inmediatas en plantas de empaque. Asimismo, se ha ordenado la supervisión de la devolución del lote afectado y se instó a las instituciones sanitarias a revisar y aislar cualquier producto perteneciente a dicho lote.
Las recomendaciones de la FDA
Se instruyó a los establecimientos de salud a identificar, cesar inmediatamente el uso y devolver los lotes pertenecientes a la remesa PG4360. Sandoz coordinó con Sedgwick, su distribuidor inverso, para recoger los envases retirados del mercado.

Los pacientes en tratamiento con Cefazolina deben consultar a su médico o farmacéutico si tienen dudas sobre el lote de su medicación. Asimismo, se aconseja informar cualquier reacción adversa al fabricante o a través del sistema local de notificación de eventos adversos, equivalente a MedWatch de la FDA.














